包阅导读总结
1. 关键词:医疗器械、纤维化、非纤维化粘附材料、免疫机制、临床应用
2. 总结:科学家发现非纤维化粘附材料,能防止医疗器械植入体内后产生纤维化,为其长期工作提供方案。该材料具有多种优势,已在多种动物模型上验证,有望用于临床,但需审批。
3. 主要内容:
– 医疗器械植入体内通常引发异物反应导致纤维化
– 蛋白吸附,免疫细胞聚集,形成纤维化组织包围设备
– 现有抑制纤维化方法不能长期完全抑制
– 发现非纤维化粘附材料
– 可将医疗植入设备与组织黏合,阻隔免疫系统攻击
– 水凝胶黏附剂抑制纤维化,为临床应用提供方案
– 研究非纤维化粘附材料的作用机制
– 减少非特异性蛋白吸附,减少炎症细胞浸润
– 早期炎症调节因子增高,7 天后显著降低
– 与组织黏附紧密减少炎症细胞记忆,遏制免疫攻击
– 非纤维化粘附材料的优势与应用
– 由大分子组成,来源广、价格低、柔软度高
– 在多种动物模型上验证抑制纤维化性能
– 已用于临时性心脏起搏器,有望用于治疗临床疾病
– 未来展望
– 希望尽早实现技术转化,推广临床人体试验,但需审批
思维导图: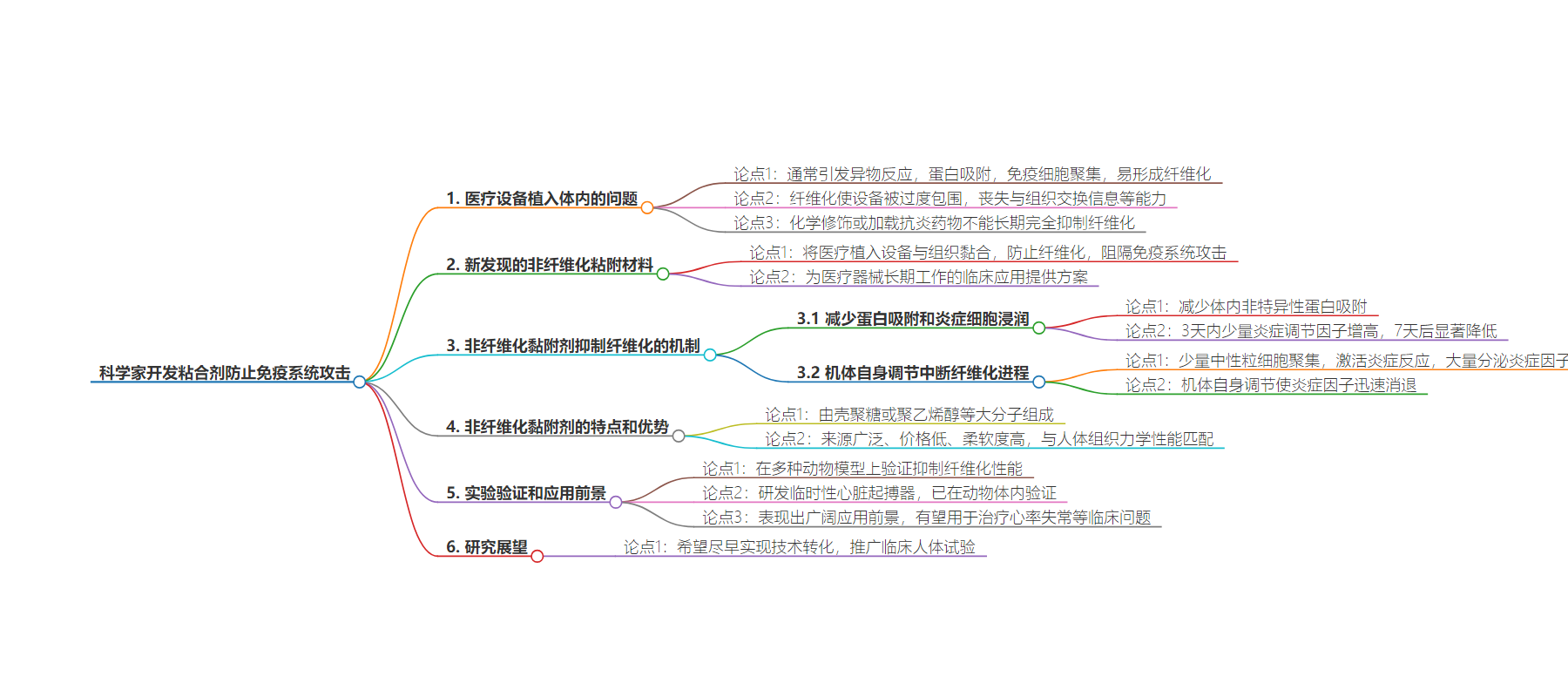
文章地址:https://mp.weixin.qq.com/s/oR4W1u8PqEJMZdxcOhGb-g
文章来源:mp.weixin.qq.com
作者:刘雅坤
发布时间:2024/8/12 10:22
语言:中文
总字数:2225字
预计阅读时间:9分钟
评分:86分
标签:医疗植入设备,纤维化抑制,生物材料,麻省理工学院,免疫系统
以下为原文内容
本内容来源于用户推荐转载,旨在分享知识与观点,如有侵权请联系删除 联系邮箱 media@ilingban.com


医疗设备(例如起搏器)或材料植入到体内后,通常会引发机体的异物反应,使蛋白吸附在设备表面,招募免疫细胞,如巨噬细胞、中性粒细胞等聚集在材料表面。
纤维化细胞聚集实现胶原的沉积容易形成纤维化,使设备被纤维化组织过度包围形成一层物理屏障,从而让材料丧失与组织交换信息或释放信号因子的能力。
基于化学修饰设备表面或加载抗炎药物的方法,虽然能够在一定程度上减少纤维化的形成,但并不能长期完全抑制这种现象。
近期,美国麻省理工学院赵选贺教授和吴晶晶博士首次发现了一种非纤维化粘附材料,可将医疗植入设备与周围组织黏合在一起,防止设备植入后产生纤维化,如同为设备穿上“隐形衣”,对免疫系统的攻击起到阻隔作用,进而延长此类设备的使用寿命。
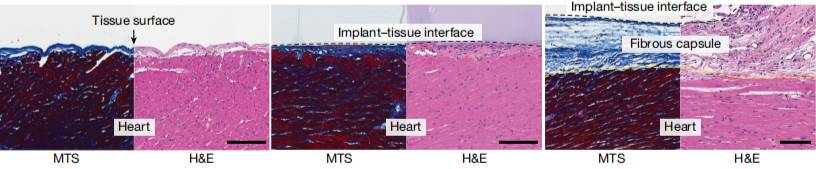
图丨粘合涂层可防止在植入物-组织界面形成纤维囊(来源:Nature)
该研究通过水凝胶黏附剂抑制纤维化形成,有望为更多医疗器械植入体内长期工作的临床应用提供方案。例如,保护体内长期药物递送、细胞递送、传感器递送等医疗设备,以长期提供治疗或者诊断功能。
美国三院院士、美国哈佛大学大卫·穆尼(David Mooney)教授对该研究评价称:“医疗器械与组织之间牢固的粘合可避免纤维化组织的形成,这是一项重要发现,在医疗器械领域具有许多潜在应用。”
近日,相关论文以《不同器官上的粘附性抗纤维化界面》(Adhesive anti-fibrotic interfaces on diverse organs)为题发表在 Nature[1]。
麻省理工学院吴晶晶博士是第一作者,赵选贺教授和 Hyunwoo Yuk 博士担任共同通讯作者。

图丨相关论文(来源:Nature)
此前,在通过黏附材料修复特殊环境下软组织器官的缺损研究中,研究人员发现黏附材料可快速修复缺损的组织,并且能促进伤口愈合[2-3]。
在该研究中,通过引入非纤维化黏附剂,减少体内非特异性蛋白(白蛋白和纤维蛋白原等)吸附,进而减少大量炎症细胞的浸润。
在研究免疫蛋白和基因组学等后,研究人员发现,3 天内只有少量的炎症调节因子增高,然而 7 天后所有的炎症因子却显著降低。
吴晶晶解释说道:“这主要归功于少量的中性粒细胞聚集在非纤维化黏附剂附近,1-3 天内 nos 2 基因表达显著增高,激活了中性粒细胞介导的炎症反应,使得炎症因子 G-CSF 和 IL-12p70 大量分泌。”

图丨吴晶晶(来源:吴晶晶)
由于机体自身调节,使炎症因子在 7 天内能迅速消退,从而中断了后续纤维化进程。非纤维化黏附剂作为涂层,在医疗设备植入体内情况下,不再产生纤维化,为在体内长期存在并工作运行提供了保障。
在研究初始阶段,该课题组在实验过程中将黏附剂植入到组织的器官,虽然观察到黏附剂可抑制纤维化的形成,但当时对于这种反常现象背后的免疫机制并没有深入了解。
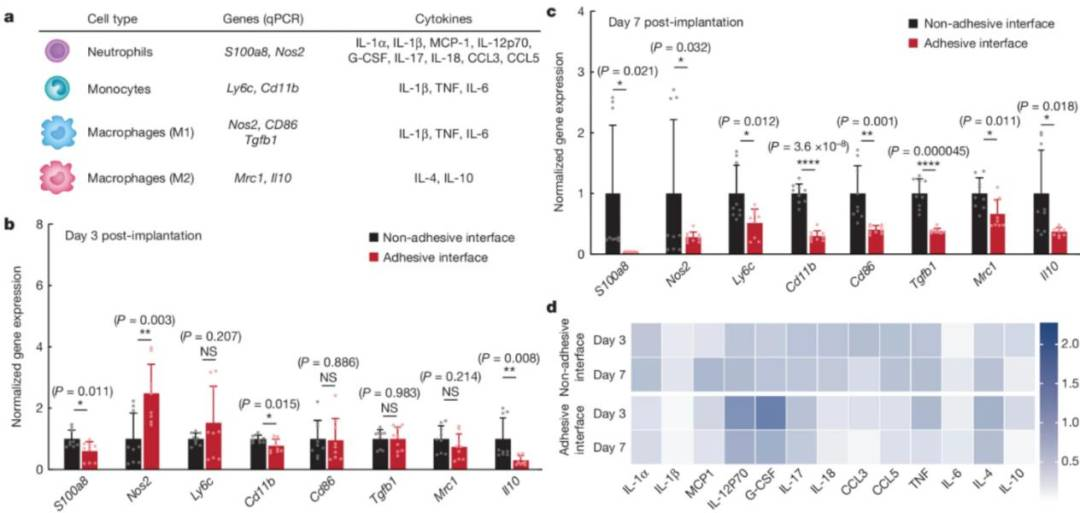
图丨黏附剂植入界面的定量聚合酶链式反应和 Luminex 分析(来源:Nature)
为探索背后的免疫学机制,该团队与合作者通过一些列生物学表征手段,包括免疫荧光、定量聚合酶链式反应、转录组测序技术等技术,分析了该现象背后的免疫学机制。
研究人员还进行多个对照组比较,发现了一种现象:如果组材料和组织黏附得紧密,会减少炎症细胞的记忆。而如果同样的材料没有黏附的性能,炎症细胞还是能够穿到材料和组织之间,导致炎症反应从而形成纤维化。
吴晶晶说:“我们发现,中性粒细胞等免疫细胞最先开始浸润该植入区域,但很快免疫攻击被遏制,阻断了纤维化组织形成的进程,三个月内植入都没有纤维化产生,且仍能保持电学信号的长期传递。”
非纤维化黏附剂是由壳聚糖或者聚乙烯醇等大分子组成的聚合物,具有来源广泛、价格低和柔软度高的优势,与人体的组织的力学性能非常匹配。
该研究解决了困扰人类已久的因材料植入体内引起异物反应,而导致纤维化的问题,让医疗器械或材料在体内长期工作成为可能。
目前,该团队已经通过实验在小鼠、大鼠、人源鼠及猪的动物模型上验证其抑制纤维化的性能。如腹壁、胃、结肠、心脏和肺等,因而非纤维黏附剂表现出广阔的应用前景。
鉴于该发现,课题组后续还研发了一种临时性心脏起搏器[4]。吴晶晶已验证黏附剂涂在心脏起搏器中植入动物体内(大鼠),可在体内持续工作。
并且,能以电刺激心脏,提供稳定的电生理信号监测和调控,有望用于治疗心率失常/心肌梗塞等临床问题。
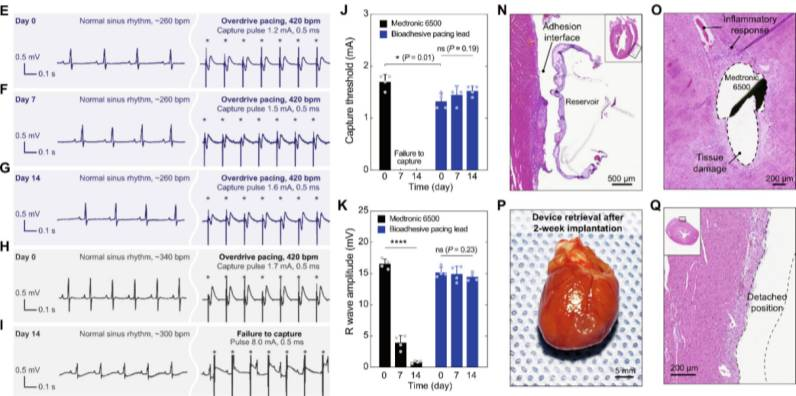
图丨大鼠模型中的连续心脏监测及起搏(来源:Science Translational Medicine)
Nature点评该研究称[5],这项研究的主要亮点是粘合剂涂层能够减轻软聚合物植入物周围瘢痕组织的形成——作者们在许多动物模型中展示了这种效果,这些动物模型将生物材料植入各种器官中或器官上。
对于植入的生物材料来说,周围疤痕组织的形成是一个普遍存在的问题,会影响其功能,研究人员所展示的是解决这一重要问题的可喜进展。
吴晶晶表示:“我们希望尽早实现技术转化,推广其在临床进行人体试验。但这需要经过严格的技术和伦理审批,预计在未来两至三年内完成。”

2.Wu, J. et al. An off-the-shelf bioadhesive patch for sutureless repair of gastrointestinal defects.Science Translational Medicine14, abh2857(2022).https://doi.org/10.1126/scitranslmed.abh2857


